L’idratazione degli alcheni è una reazione che permette di trasformare un alchene in un alcol.
Stereochimica
L’idratazione degli alcheni è una reazione non stereospecifica questo significa che, se si forma un centro chirale, potrà essere sia (S) che (R).
Inoltre, fai attenzione ad un’altra cosa.
Dove si aggiunge il gruppo OH? Si lega al carbonio più sostituito (tra i due del doppio legame). Al contrario, l’H+ si lega al meno sostituito. La reazione è quindi regiospecifica (detto a parole mie “non si legano alla cazzum”) visto che segue la regola di Markovnikov.

Ti mostro il meccanismo della reazione.
Prima voglio farti una premessa importante. Se ho un alchene in cui entrambe i carboni del doppio legame sono sostituiti in modo uguale come ad esempio nel 2-propene? Semplice, è indifferente! Puoi legare l’OH in uno dei due carboni. Tranquillo, ti mostrerò anche questo caso tra poco.
Meccanismo della Reazione
Il primo stadio dell’Idratazione degli alcheni è mettere il composto in ambiente acido. Generalmente si utilizza l’acido solforico. Questo andrà a protonare (aggiungere un idrogeno) il carbonio meno sostituito, che in questo caso è quello di destra. Si forma come intermedio un carbocatione.
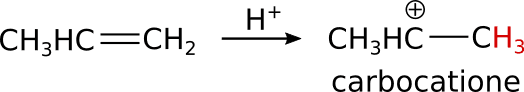
Quando ottieni come intermedio un carbocatione, devi sempre chiederti se può avvenire la trasposizione per formarne uno più stabile.
Dopo vediamo come (anche con un apposito esercizio svolto).
Come procedo con il meccanismo? Faccio reagire il carbocatione (forte elettrofilo) con l’acqua (nucleofilo debole). Gli elettroni dell’ossigeno si legano al carbonio carico +, ripristinando la sua neutralità (se un carbonio fa 4 legami è neutro). Però, l’ossigeno ora fa 3 legami, di conseguenza diventa lui carico positivamente.
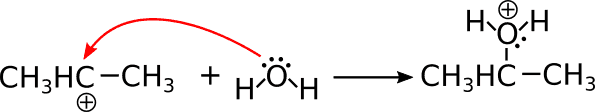
Infine, si deprotona l’ossigeno in modo da ristabilire la sua neutralità.
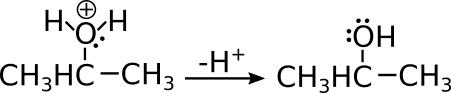
Si ottiene così l’alcol, in questo caso è il 2-propanolo.
Esercizio #2:
Vediamo come funziona l’idratazione prendendo come alchene di partenza il 2-butene. In questo caso, entrambe i carboni coinvolti nel doppio legame sono sostituiti in modo uguale [tutti e due legano un gruppo metilico (-CH3)].
Quindi, come faccio ora a rispettare la regola di regola di Markovnikov? Come ti ho accennato anche prima, in questo caso è indifferente!

Adesso devo chiedermi, posso formare un carbocatione più sostituito spostando la carica positiva? Vediamo, ora ho un carbocatione secondario:
- se la sposto sul carbonio di sinistra mi diventa un carbocatione primario (quindi meno stabile del secondario);
- se la soposto sul carbonio di destra mi diventa un secondario, di conseguenza uguale a quello che ho adesso;
Quindi, neanche in questo esercizio tengo conto del ri-arrangiamento.
Continuo con la reazione facendo reagire il mio intermedio carbocationico con una molecola di acqua.

Infine deprotono per formare l’alcol.

Attenzione: in questo caso si forma un centro chirale! Ricorda che ottieni entrambi gli enantiomeri (S) + (R) del 2-butanolo.
Esercizio #3
Vediamo infine un altro caso molto interessante, ovvero la reazione di idratazione degli alcheni, fatta su un 3-metil-1-butene. Cos’ha di particolare?
Lo scoprirai tra pochissimo!
Per prima cosa ovviamente metto l’alchene in ambiente acido per formare il carbocatione.

Adesso, fai molta attenzione, perché il carbocatione che si è formato può riarrangiarsi. Infatti, se la carica positiva si sposta sul carbonio di sinistra, diventa terziario (che è il carbocatione più stabile in assoluto).
Come si procede? Metto in evidenza un protone del carbonio di sinistra e faccio vedere che si andrà a legare (utilizzando i suoi elettroni di legame) al carbonio carico +, neutralizzando così la sua carica. Però se gli elettroni si sono spostati, significa che il carbonio di sinistra ora è diventato povero di elettroni (carico +).

Adesso, posso proseguire normalmente con la reazione, facendo reagire questo intermedio con una molecola di acqua.

Infine, come da prassi vado a deprotonare e l’alcol è pronto!

Fai molta attenzione, perché il 2-metil-2-butanolo è l’alcol che ottieni dal carbocatione terziario, ed è quindi il prodotto principale. Però, si formerà anche l’alcol che deriva dall’intermedio secondario.
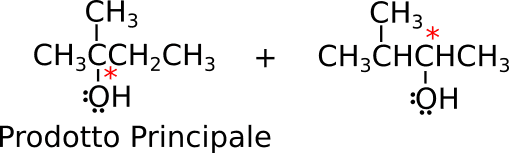
Infine, considera che nella seconda molecola si è formato un centro chirale, quindi ottengo complessivamente 3 prodotti:
- 2-metil-2-butanolo
- (S)-3-metil-2-butanolo
- (R)-3-metil-2-butanolo
Infine, se vuoi sintetizzare un alcol in cui i 2 sostituenti si legano al contrario (alcol anti-Markovnikov)? Ti basta utilizzare un’altra reazione, ovvero l’idroborazione ossidazione.
Per questa guida è tutto, mi raccomando se non l’hai ancora fatto, iscriviti al canale Youtube e premi anche sulla campanellina che appare dopo l’iscrizione (sarai così sicuro di ricevere i video gratuiti)…