Il carbonio chirale rappresenta una colonna portante della chimica organica. Cerca quindi di prestare moltissima attenzione a ciò che leggerai in questa pagina, e mi raccomando, fai anche gli esercizi!
Tra poco troverai tutto ciò che nessuno ha mai osato dirti (e che devi conoscere a menadito) sul carbonio chirale.
Innanzitutto, cos’è un centro chirale?
Un centro chirale, altro non è che un atomo (nel 99% dei casi si tratterà di un carbonio), legato a 4 gruppi/atomi diversi. Sotto ti riporto un esempio di carbonio chirale, che è legato a 4 gruppi/atomi diversi:

- Idrogeno (H)
- Gruppo Metilico (CH3)
- Gruppo Etilico (CH2CH3)
- Bromo (Br)
Quindi, il Carbonio al centro, lo definiremo un carbonio chirale e, generalmente si indica con un asterisco. Probabilmente sentirai qualcuno chiamarlo centro asimmetrico, devi sapere che è semplicemente un sinonimo. Perché abbiamo detto che è un pilastro importantissimo? Te lo spiego subito.
Segreto #1: un carbonio è un centro chirale, solo e soltanto se lega 4 sostituenti diversi. Se lo è, può trovarsi in due forme: (S) oppure (R).
Guarda la tua mano destra, ora guarda la tua mano sinistra. Sono perfettamente uguali. Stesse ossa, stessa pelle (non considerare ovviamente gli anelli/tatuaggi, ecc). C’è un “però”, sono una speculari l’una all’altra. Quindi, se metti davanti allo specchio la tua mano destra, l’immagine che vedrai in questo è quella della tua mano sinistra, e viceversa. Inoltre, se le rivolgi sullo stesso lato (o palmo o dorso), non sono sovrapponibili.
Allo stesso modo, un centro chirale, può essere (R) oppure (S). Se metti un carbonio chirale (S) di fronte ad uno specchio, il riflesso sarà l’isomero con la configurazione (R) e viceversa. Gli stessi atomi, gli stessi gruppi, ma con la differenza che sono disposti in modo diverso nello spazio, e questo influenza molto le caratteristiche. Proprio dalla similitudine con le mani (in greco chiros), deriva il nome centro chirale.

Cosa cambia tra la conformazione S e R? Sembrano la stessa molecola, in realtà sono molecole diverse. Prendi ad esempio un farmaco. Magari la molecola con il centro chirale (R) potrebbe essere un farmaco eccezionale e quella con una configurazione (S) invece una molecola estremamente tossica. Per questo i professori insistono molto nel farvi capire la stereochimica. Se aspiri ad essere un chimico, non capire la stereochimica, è come per un barista non saper fare un maledetto caffè.
Non è tutto.
Un’altra informazione importante per quanto riguarda l’isomeria ottica è questa: le due molecole in cui differisce solo un centro chirale (quindi una avrà un carbonio chirale R e l’altra S), vengono definite enantiomeri (attenzione, perché questo è valido solo se nella molecola c’è un solo centro asimmetrico).
Qui arriva il bello, come sai se una è “R” oppure “S” (che in fin dei conti è l’unica informazione che conta)? Te lo spiego subito, ma prima dai un’occhiata alle proprietà di questi benedetti enantiomeri.
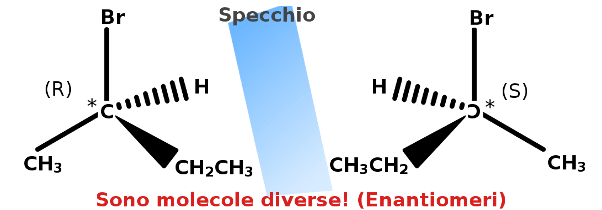
Segreto #2: l’unica cosa da sapere in un centro chirale, è che può essere (S) oppure (R). Se non vuoi ricevere una bastonata in fronte da un chimico, non dire mai che si tratta della stessa molecola (oppure “vabbé dai, tanto è uguale”, no, non è uguale!).
Proprietà degli enantiomeri:
- Stesse proprietà fisiche (punto di ebollizione, punto di fusione, densità, solubilità);
- Diversa direzione di rotazione del piano della luce polarizzata;
- Anche se potrebbe sembrare, NON sono la stessa molecola;
Come capire se un Centro chirale è R oppure S?
Si utilizzano le regole di sequenza di Cahn-Ingold-Prelog.
- Si assegna un numero ai quattro sostituenti diversi legati al carbonio chirale, secondo la loro priorità, da 1 a 4 (dove 1 è la priorità massima e 4 è la minima);
- La priorità viene assegnata a seconda del numero atomico dell’atomo che lega direttamente il carbonio chirale, in genere ci troveremo davanti questi una selezione di questi atomi: Br (Bromo), Cl (Cloro), O (Ossigeno), N (Azoto), C (Carbonio) e H (Idrogeno). [Tranquillo, tra poco ti illustrerò il trucchetto mnemonico che ho creato per ricordare la priorità tra questi, senza errori, così al compito non avrai il minimo dubbio];
- Se due atomi sono identici, la priorità si determina sul primo punto di differenza lungo la catena;
- Gli atomi legati ad un doppio o triplo legame, si considerano come se fossero legati ad un numero equivalente di legami semplici (ad esempio: un carbonio che fa un doppio legame con l’ossigeno, si considera come un carbonio che lega due ossigeni)
Sembrano regole complicate? La realtà è che è “molto più facile a farsi piuttosto che a spiegarlo”. Il modo migliore per capirle è mettere tutto in pratica, e fare talmente tanti esercizi da farlo entrare nella zona più profonda del tuo cervello, in modo che ci resti per sempre.

Trucchetto mnemonico per ricordare le priorità tra gli atomi: Innanzitutto la priorità è questa: Br>Cl>O>N>C>H. Ora, per ricordarla, ho ideato questo semplice trucchetto. Pensa ad un BRacCiaLettO di NiCHel. Ecco fatto, in un secondo hai già memorizzato le priorità degli atomi. (Mi hanno già detto che alcuni soggetti me lo stanno fottendo questo trucchetto, addirittura spacciandolo per loro, mi dispiace per il loro intelletto che non è in grado di crearli)…
Esercizi svolti di stereochimica
Quindi, ricapitolando quel 20% di teoria che ti serve è questo. Quando c’è un carbonio con quattro sostituenti diversi, si tratterà di un carbonio chirale, e potrà di conseguenza essere (S) oppure (R) [che tra loro vengono chiamati enantiomeri]. Gli enantiomeri, anche se sono simili, in realtà sono molecole diverse.
- Per capire la configurazione (r oppure s) del carbonio chirale, bisogna innanzitutto scrivere il carbonio nella struttura a tratti e cunei, oppure nella proiezione di Fischer.
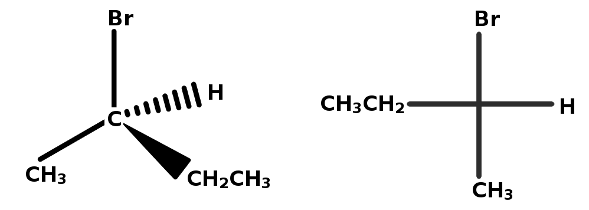
In questa pagina vedremo la più utilizzata, la struttura a cunei e tratteggi, mentre in quest’altra guida trovi come funziona per le proiezioni di Fischer.
Una condizione importante è che bisogna avere il gruppo a priorità 4 (generalmente l’idrogeno) sul cuneo tratteggiato (dietro al piano) o su quello pieno (davanti al piano). Altrimenti c’è bisogno di fare una procedura che vedremo in seguito.
Segreto #3: per vedere se un carbonio chirale è (S) oppure (R), devi NECESSARIAMENTE avere il gruppo a priorità 4 davanti o dietro al piano (rispettivamente cuneo pieno e tratteggiato).
Primo caso: gruppo a priorità 4 dietro al piano (cuneo tratteggiato)
Si assegna la priorità ai gruppi e si vede la direzione, dall’uno al due (senza passare per il tre). Se la direzione è oraria, allora è (R), se è antioraria è (S).

Il trucchetto mnemonico che ho ideato per ricordare questa cosa è: direzione verso Sinistra (che inizia appunto per S) è (S), invece verso destra (che in inglese si dice Right) è (R).
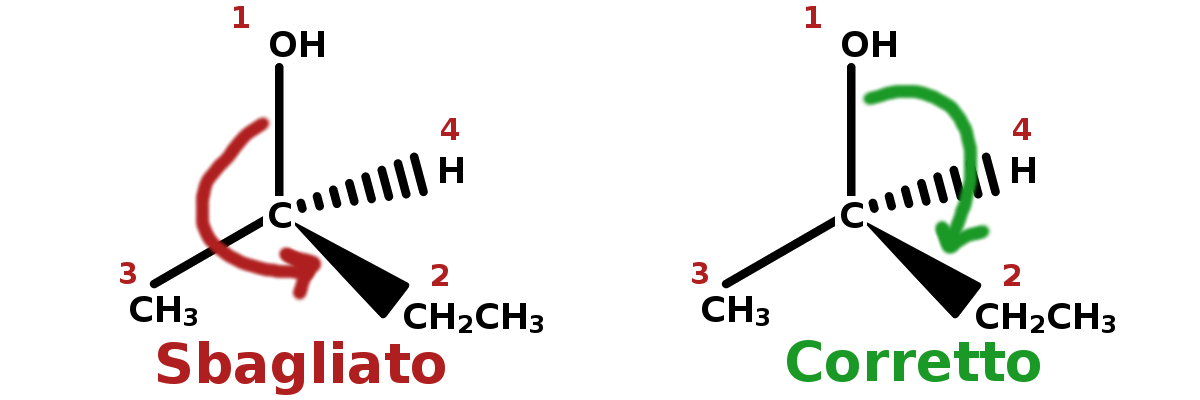
Esercizio: per prima cosa assegno le priorità. I primi atomi che incontro partendo dal carbonio chirale sono: 1 Ossigeno, 2 Carboni e 1 Idrogeno. Tra questi tre, l’ossigeno ha la priorità più alta (1), e sicuramente l’idrogeno la più bassa (4). Ora, mancano le priorità 2 e 3.
Ho un Ch3 e un Ch2Ch3, quindi da una parte un carbonio legato a soli idrogeni, mentre dall’altra un carbonio che lega un carbonio al posto di un idrogeno. Quindi quest’ultimo avrà la priorità più alta (2). Adesso, per capire l’isomeria ottica, dobbiamo andare dal gruppo a priorità uno al gruppo a priorità due senza passare per il tre. In questo caso il senso è orario e il gruppo a priorità 4 è dietro al piano, quindi la configurazione è (R).
Secondo caso: gruppo a priorità 4 davanti al piano (cuneo pieno)
Se un carbonio chirale presenta il gruppo a priorità 4 sul cuneo pieno (si trova quindi dietro al piano), è sufficiente vedere la configurazione (come faresti normalmente), per poi invertirla. Quindi, se otteniamo la configurazione(R) diventerà (S) e viceversa.
Segreto #4: dopo aver assegnato la configurazione, si traccia mentalmente un percorso che va dall’uno al due (senza passare per il tre) e si vede la direzione. Ora, se il gruppo a priorità 4 si trova sul cuneo tratteggiato, ed il tracciato è verso sinistra è (S) mentre se è in movimento orario è (R). Il contrario se il gruppo a priorità 4 si trova davanti al piano (cuneo pieno).
La teoria in merito all’isomeria ottica è quasi terminata. Mancano alcune cose che vedremo mano a mano, proseguendo in questa “guida”. Ora è fondamentale ammazzarsi di esercizi. Li trovi di seguito (Si, sono svolti!).
Esercizi: assegna la stereochimica ai seguenti centri chirali
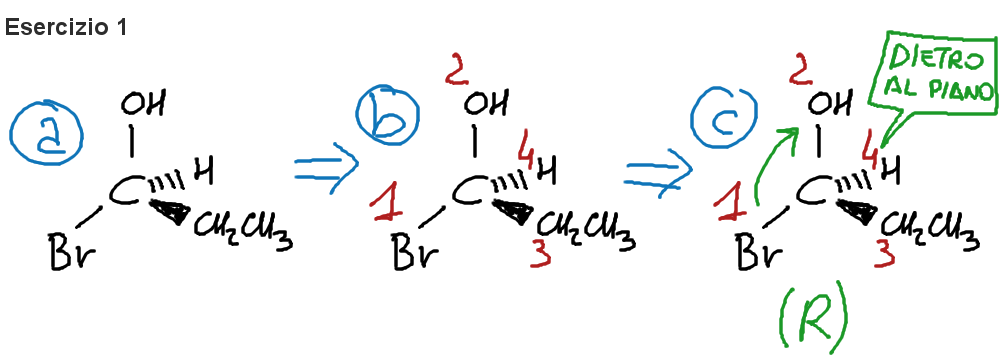
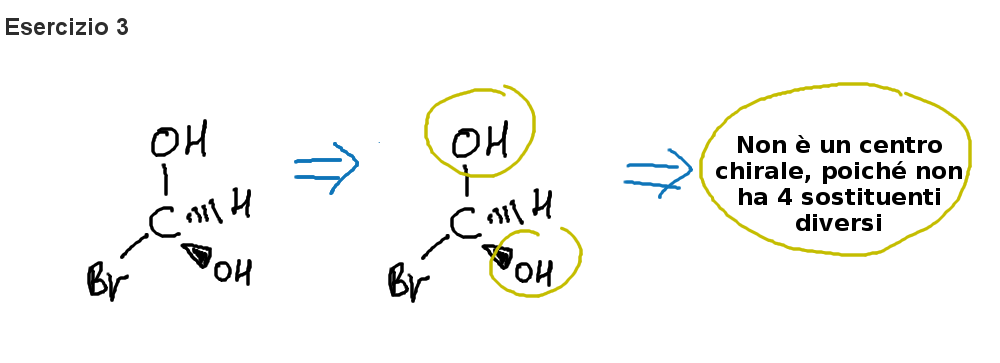
Commento dell’esercizio 1:
- abbiamo la molecola e noto che il carbonio centrale è chirale, poiché è legato a 4 sostituenti diversi;
- assegno la priorità ai sostituenti, ricordando che Br>Cl>O>N>C>H. Quindi l’uno al Bromo, il due al gruppo idrossi (OH), il tre al gruppo etilico (Ch2Ch3) ed infine il 4 all’idrogeno;
- traccio una linea mentale dal gruppo a priorità uno verso il gruppo a priorità due (senza passare per il gruppo a priorità tre), quindi in questo caso il senso è orario, di conseguenza la configurazione è (R) (visto che il gruppo a priorità 4 si trova sul cuneo tratteggiato)
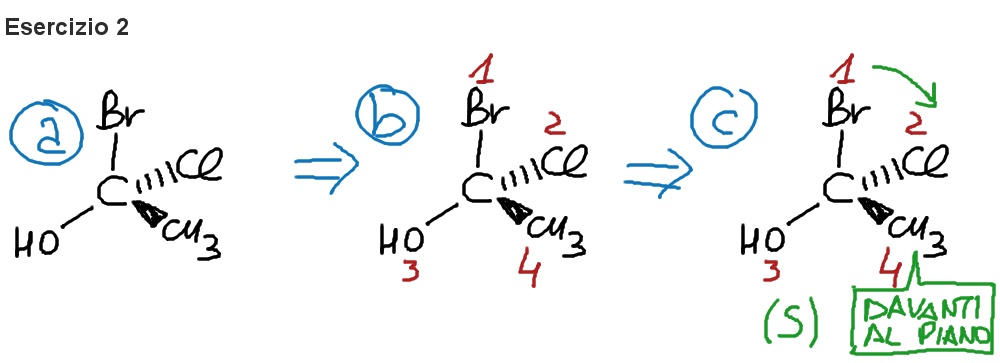
Commento all’esercizio 2:
- b) N.B. In questo caso il gruppo a priorità 4, non è un idrogeno, ma un gruppo metilico;
- c) il senso è orario, ma visto che il gruppo metilico si trova davanti al piano, si inverte la configurazione, quindi è (S).