Le strutture di risonanza, nella chimica organica, rappresentano una delle bestie nere.
Perché?
Secondo me è tutta una questione psicologica.
Ti faccio un esempio: quando facevo il tutor, nessuno voleva svolgerle alla lavagna. Così facevo il bas***do.
Ponevo una semplice domanda: “chi di voi non riuscirà MAI e poi MAI a capire le strutture di risonanza?”. Ovviamente tanti alzavano la mano. Che facevo allora? Li chiamavo alla lavagna!
Gli assegnavo un esercizio sulle strutture limite (di risonanza) , da svolgere davanti a tutti. La cosa bella? Dopo qualche “dritta”, magicamente riuscivano a disegnarle!
Dal “non ci riuscirò mai e poi mai” al farcela davvero sono trascorsi giusto quei 2 minuti ed un paio di consigli.
Ovviamente, se ti do delle “dritte” di persona è un’altro conto. Però cercherò di parlarti qui, il più chiaramente possibile, su come capire le strutture di risonanza e ti mostrerò anche numerosi esercizi svolti. In questo modo, ogni volta che te le ritroverai davanti, riuscirai a disegnarle.
Come disegnare le strutture di risonanza
Disegnare le strutture di risonanza è molto semplice se le comprendi al meglio.
Sai perché? Una volta che che sai scrivere la prima, le altre verranno da sé.
Sostanzialmente cosa succede negli ibridi di risonanza?
Che gli elettroni si muovono, spostando di conseguenza una carica (positiva o negativa). Soltanto questo devi capire? Si!
Tutto dipende dallo spostamento di elettroni. Ricorda sempre che:
- la carica negativa indica che l’atomo è ricco di elettroni;
- la carica positiva invece indica che ne è povero;
Quindi, basta capire come si muovono gli elettroni ed il gioco è fatto. Vediamo come negli esercizi in basso.
Strutture di Risonanza del fenossido (anione del fenolo)
Un esercizio svolto molto utile è sicuramente quello che ti mostrerò adesso con il fenossido (o puoi chiamarlo anche fenato).
È utile per diversi motivi. Innanzitutto te lo ritroverai nella sintesi di Kolbe (per la sintesi dell’acido acetilsalicilico). Inoltre, le strutture di risonanza del fenato spiegano perché il fenolo è più acido rispetto agli altri alcol (ma di questo ne parlerò dopo, o nella prossima “puntata”).
Come si prepara il fenato?
Si tratta del fenolo deprotonato, quindi – per crearlo – basta semplicemente far reagire il fenolo con una base forte come l’idrossido di sodio (NaOH) ed otterrai il fenossido di sodio.

Ora che ho sintetizzato lo ione fenato, ne scrivo le strutture di risonanza.
Come possono spostarsi gli elettroni per far risuonare la carica negativa negli altri atomi?
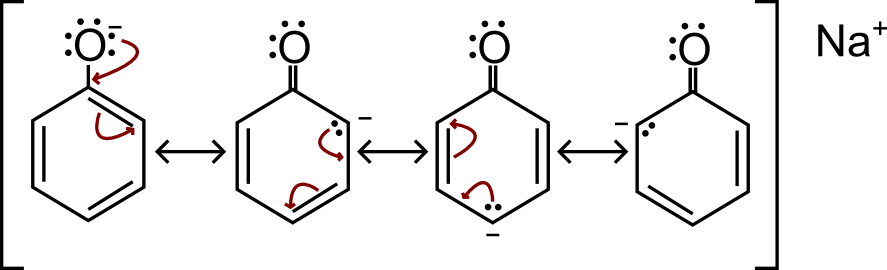
Guarda la prima struttura, l’ossigeno ha una carica negativa. Come sai/dovresti sapere, un atomo che ha una carica non è stabile e fa di tutto per tornare neutro. Come può fare in questo caso? Utilizzando gli elettroni per formare un legame con il carbonio (vedi le frecce). Il carbonio non può fare 5 legami, quindi rompe il doppio legame che c’è e gli elettroni vanno a finire nell’altro carbonio.
Nella seconda risonanza, puoi vedere che il carbonio che ha preso gli elettroni di legame, ha di conseguenza assunto una carica negativa. Questo perché non ha 4 legami, ma bensì 3 legami (ricorda che c’è un legame con l’idrogeno che viene omesso) e 2 elettroni liberi. Proprio come l’ossigeno, vuole tornare neutro (un carbonio è neutro quando fa 4 legami). Quindi, utilizza gli elettroni per fare il doppio legame. Come successo prima l’altro carbonio non può fare 5 legami e deve rompere il doppio legame che già c’è. Questa cosa si ripeterà anche nella terza struttura.
Esercizi svolti sugli Acidi Carbossilici
Gli acidi carbossilici, devono la loro acidità anche al fatto di avere uno ione coniugato stabilizzato per risonanza. In poche parole, quando cedono il proprio idrogeno, lo ione che si crea, è stabilizzato dalle strutture di risonanza. Tutti gli acidi carbossilici hanno strutture limite simili. Voglio farti vedere qualche esempio con l’acido benzoico e l’acido acetico.
Acido acetico
La prima cosa che faccio è quella di scrivere la molecola dell’acido acetico, per poi deprotonarla. Utilizzo una base forte, come ad esempo l’idrossido di sodio, ed ottengo l’acetato di sodio. Ah, quasi dimenticavo, il nome si assegna così: da acido acetico, diventa acetato.

Ti mostro adesso le strutture di risonanza dell’acido acetico, o meglio del suo anione.

Acido Benzoico
Visto che si tratta di un acido carbossilico, le strutture di risonanza dell’acido benzoico (del suo anione), sono praticamente la fotocopia di quelle viste prima. Il primo passaggio ovviamente è quello di creare il benzoato, utilizzerò come sempre l’idrossido di sodio.


Esercizio svolto sull’Ozono (O3)
Nell’ultimo esercizio svolto sulle strutture di risonanza voglio mostrarti quelle dell’Ozono (O3). Le ritroverai anche nell’ozonolisi. Sembra leggermente più complicato rispetto alle risonanze viste fino ad ora, ma si basano tutte sullo stesso principio. Te lo riassumo in parole povere: se c’è un atomo carico (+ o – ), è instabile, quindi fa di tutto per tornare neutro. Se ci sono elettroni vicini (anche gli elettroni dei doppi legami) che possono muoversi per neutralizzare la carica, lo faranno.
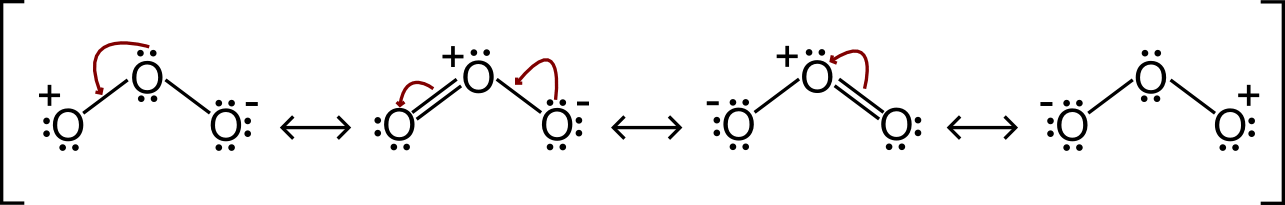
Come vedi nella prima risonanza, gli elettroni del carbonio centrale si muovono per neutralizzare la carica + (cosa che succederà anche nelle altre!) dell’ossigeno di sinistra. Dopodiché, nella seconda, accade praticamente la stessa cosa. Ma con una piccola differenza.
Gli elettroni dell’ossigeno di destra andranno a neutralizzare la carica positiva, ma l’ossigeno centrale non può fare più di tre legami, quindi deve per forza di cose rompere il doppio legame con l’ossigeno di sinistra. Anche nella terza, semplicemente gli elettroni del doppio legame faranno la stessa cosa (neutralizzano la carica +) ed otterrò così la quarta struttura di risonanza che – se ci fai caso – è speculare alla prima.
[learn_more caption=”Approfondimenti”] Vedendo la molecola, si vede anche che per l’ozono, non è possibile scrivere strutture di lewis senza separazione di carica. Detto in altre parole, anche se nella sua totalità la molecola è neutra (visto che c’è una carica + ed una – che si “annullano” a vicenda), non è possibile scriverla con tutti gli atomi neutri.[/learn_more]






