Cos’hanno di speciale i composti aromatici? Si OK, hanno la particolarità di essere profumati (da qui il nome “aromatici”), ma di questo nella chimica organica ce ne frega poco.
La proprietà fondamentale di questi composti (chiamati anche idrocarburi aromatici), è la stabilità.
Considera infine che molti farmaci (adesso non ho le statistiche alla mano), ma quasi sicuramente oltre il 65% contengono almeno una porzione aromatica.
Ecco cosa vedrai in questa pagina:
- il benzene e la scoperta di Kekulé
- Stabilità e Reazioni
- Come riconoscere i composti aromatici? (3 regole)
- La regola di Huckel (4n + 2)
- Molecole Aromatiche più importanti (e attenzione a questo errore)
- Posizioni Orto, Meta e Para
Il benzene e la scoperta di Kekulé
Il benzene rappresenta il composto aromatico per eccellenza. La struttura del benzene (la cui formula è C6H6) è quella che vedi in basso (sono uguali, solo che a destra ho omesso gli idrogeni).
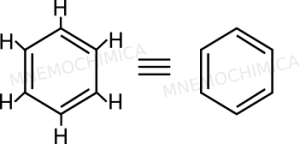
Friedrich August Kekulé fu il primo a capire che non erano tre semplici legami, ma formavano qualcosa che andava ben oltre. Non sapeva però spiegarselo, finché un giorno non fece un sogno strano. Sognò gli atomi e tutto ad un tratto dei serpenti. Tra questi ce n’era uno che si mordeva la coda.
Si svegliò tutto d’un tratto ed elaborò la sua tesi per tutta la notte. Capì così che gli elettroni dei doppi legami si muovevano (risuonavano) in modo talmente veloce da formare un unico sistema circolare: il sistema aromatico.
Vedi quanto può essere figo – a volte – fare lo scienziato?
Nell’immagine puoi vedere nella pratica la scoperta di Kekulé, dove gli elettroni risuonano in quello che io chiamo unico “mega doppio legame”.
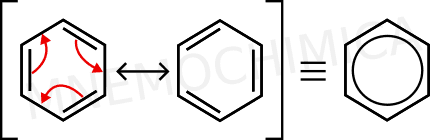
Stabilità e Reazioni
Gli idrocarburi aromatici hanno la caratteristica di essere molto stabili, proprio grazie all’anello aromatico. Io consiglio sempre di pensare alla stabilità come alla “comodità”: immagina di stare sdraiato bello comodo a ca**eggiare con il cellulare in mano. Immagino che in quel momento non hai voglia di fare niente.
Allo stesso modo, i composti aromatici stanno bene così, non hanno voglia di reagire.
Infatti, anche se vedi dei doppi legami, non reagiscono come gli alcheni, ma solo con alcuni tipi di reazioni dove sono “costretti loro malgrado” a reagire: la sostituzione elettrofila aromatica e la sostituzione nucleofila aromatica.
Come riconoscere i composti aromatici? (3 regole)
Nella chimica organica ci sono una serie di regole per capire se un composto è effettivamente aromatico, oppure no. Ti elencherò prima quali sono, per poi farti degli esempi pratici.
- Innanzitutto deve essere ciclica. Questo è il primo requisito;
- In secondo luogo, tutti gli atomi del ciclo devono essere ibridati sp2.
Ti ricordi che significa l’ibridazione sp2? Che ci sono 3 orbitali sp2 + 1 orbitale p. Proprio in questi ultimo (orbitale p), risuoneranno gli elettroni del sistema aromatico.
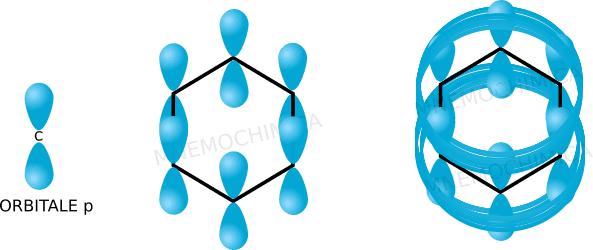
Nella prima puoi vedere come l’orbitale p si trova sia sopra che sotto il piano rispetto ad un atomo di carbonio. Nella seconda ovviamente li vedi in tutto il ciclo e nella terza puoi vedere all’opera il sistema aromatico in cui gli elettroni si muovono in una sorta di “circuito automobilistico in 3D“. La conseguenza è una molecola molto stabile.
3. Il numero di elettroni negli orbitali p, deve essere 4n + 2;
La regola di Huckel (4n + 2)
La regola di Huckel permette di capire in meno di 1 secondo se un idrocarburo è aromatico. Come? Si contano gli elettroni che si trovano nell’orbitale p, e se combaciano con la regola 4n+2 (dove “n” è un numero intero, es: n=1,2,3,…), allora significa che il composto è aromatico. Nella stragrande maggioranza dei casi, ti basterà ricordare 3 numeri in croce (anzi, nel 90% dei casi solo 1), poi ti dico quali. Ma prima ti faccio un esempio.

Il benzene è aromatico? Bhé, ne è l’esempio per eccellenza. Ma verifichiamo se è davvero così o se magari gli scienziati – incluso Kekulé con i suoi sogni – si sono confusi. Conto gli elettroni nell’orbitale p, in questo caso direttamente quelli del doppio legame e quanti ce ne sono (ricorda, 2 elettroni per ogni legame π).
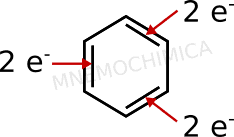
Come vedi dall’immagine, ci sono 6 elettroni. Applico la regola 4n+2. e se faccio valere n=1, diventa 4×1+2=6. Ok, se ha 6 elettroni il composto è aromatico! Gli scienziati possono continuare a dormire sonni tranquilli.
Ti mostro adesso il naftalene, il più semplice degli idrocarburi aromatici policiclici (con 2 o più anelli legati insieme). Anche in questo caso vado a contare gli elettroni dei doppi legami, perché sicuramente si trovano nell’orbitale p.
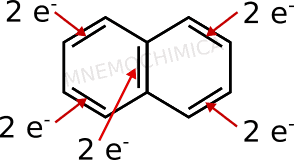
Ce ne sono 10. Se faccio valere n=2, diventa 4×2+2=10. Perfetto, anche questo è ok.

P.S. Nella maggior parte dei casi ti basterà ricordare semplicemente 6 (nel 90% dei casi), 10 e 14 elettroni, senza doverti mettere a fare il calcolo ogni volta.
Attenzione a non confonderti
Vuoi vedere anche qualche composto che invece sembra aromatico ma non lo è? Guarda questi due esempi che somigliano molto alle molecole già viste.
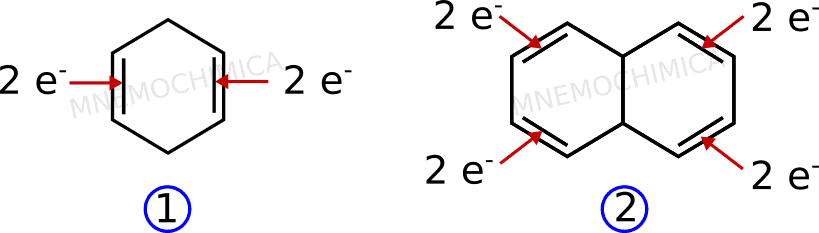
Come puoi vedere, nel #1 ci sono 4 elettroni π, mentre nel #2 ce ne sono 8. In nessun caso con la regola di Huckel, 4n+2 potrò ottenere 4 o 8, di conseguenza non sono aromatici.
Molecole Aromatiche più importanti (e attenzione a questo errore)
I composti aromatici più importanti sono generalmente quelli che hanno 6 elettroni negli orbitali p. Nel benzene questi sono evidenti perché sono quelli che formano i doppi legami, mentre in molecole come il furano, i 2 elettroni li condivide l’atomo di ossigeno.
Attenzione: ricorda che il requisito è l’ibridzione sp2 degli atomi che compongono il ciclo. Sp2 significa che c’è un solo orbitale p per ogni atomo. Per farla breve, puoi contare al massimo 2 elettroni per ogni atomo.
Ti mostro proprio l’esempio pratico del furano, dove considero solo 1 dei 2 doppietti liberi dell’ossigeno.

Come vedi, il totale fa sei e quindi lo annovero tra le sostanze “profumate”.
Ecco la lista delle molecole più importanti con 6 e– :
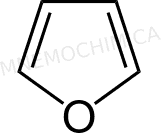
Furano | 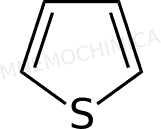
Tiofene (tiofurano) |
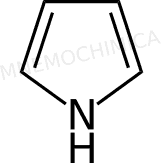
Pirrolo | 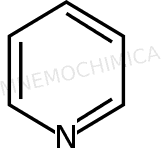
Piridina |
Posizioni Orto, Meta e Para
Quando questo tipo di idrocarburi legano 2 sostituenti diversi, questi ultimi possono essere messi in relazione tra loro con i termini orto, meta e para. Dove, con il termine:
- orto, si indica che i sostituenti si trovano legati ad atomi adiacenti;
- meta, ad un atomo di distanza;
- para, in posizioni opposte;
Per capire al meglio questa tipologia di nomenclatura, ti consiglio di leggere questa guida sulle posizioni orto meta para.