Vediamo 3 regole semplicissime per capire l’acidità degli alcoli, i pka e soprattutto scoprirai come mai i fenoli sono più acidi.
Prima però, allarme spoiler: gli alcoli – tranne rare eccezioni – non sono degli acidi (come lo sono ad esempio gli acidi carbossilici)!
Per intenderci, il pka (valore che misura proprio l’acidità) è molto vicino a quello dell’acqua. Tu l’acqua (e l’etanolo quando ti sbronzi) te li bevi tranquillamente, cosa che ti sconsiglio di fare con un acido “vero” (come ad esempio gli acidi carbossilici o l’acido cloridrico).
Cosa troverai in questa guida:
Pka degli alcoli (e fenoli)
Il pka degli alcoli va da 15,5 a 18, a seconda della catena alchilica. Più è basso il pka e più è acido un composto. Se l’alcol è:
- metilico, pka 15,5;
- primario, pka 16;
- secondario, pka 17;
- terziario, pka 18;
Invece il fenolo (alcol aromatico) ha un pka di circa 10. La differenza è mostruosa. Considera che si parla in scala logaritmica e dunque la differenza tra 16 e 10 non è 6, ma è di 106 (10 elevato alla sesta), dunque 1000000 volte più acido.
Tabella con i pka degli alcoli
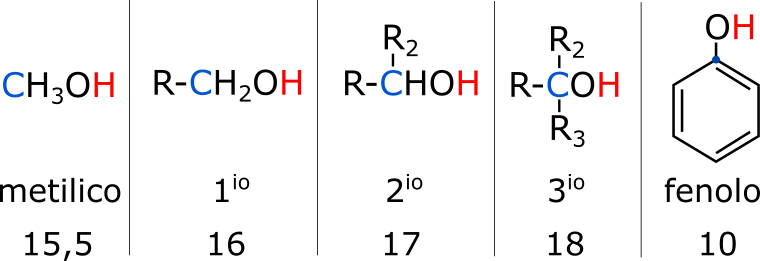
Guarda il carbonio alfa (blu nell’immagine sopra), ovvero quello che lega direttamente il gruppo ossidrilico. Come puoi vedere, più catene carboniose leghi al carbonio alfa e più diminuisci l’acidità. Infatti, i gruppi alchilici (es: -CH3, -CH2CH3 indicati genericamente con il simbolo “R”) diminuiscono l’acidità per effetto elettron donatore.
Proprio per questo motivo, l’etanolo (primario – pka 16) è più acido dell’1-metiletanolo (secondario – pka 17).
Per il fenolo invece c’è un altro discorso da fare.
Come mai il Fenolo è più acido?
Guarda l’immagine in basso, ti mostro cosa succede se deprotoni un alcol semplice ed un fenolo.
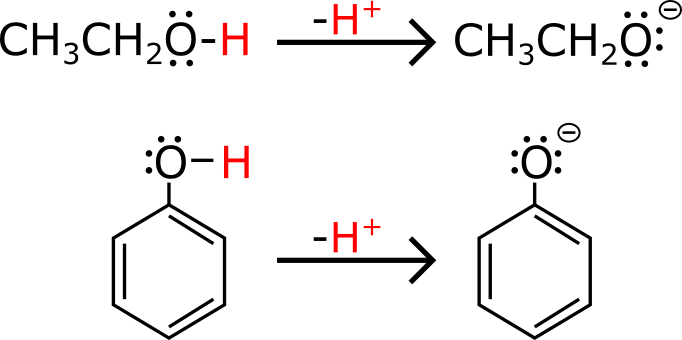
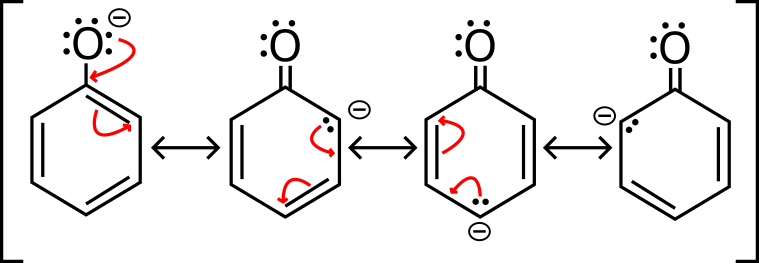
Uguale giusto? La differenza sta nella stabilità della base coniugata. Se deprotoni (togli un H+) un fenolo, scopri che la sua base coniugata (ione fenato) è stabilizzata grazie a 4 strutture di risonanza (che invece non hai nell’etanolo deprotonato).
Ricorda che più è stabile la base coniugata (e in questo caso è stabilizzata dalle 4 risonanze) e più è acido un composto. Invece, se deprotoni un alcol normale, non ottieni risonanze e dunque non hai questa “extra-stabilizzazione”.
Questa “extra stabilizzazione” è dovuta all’effetto mesomerico (nome di cacca che indica proprio la stabilizzazione per risonanza).
Puoi approfondire il discorso sull’acidità con diversi esercizi svolti, in questa guida.