Un esercizio molto richiesto dai prof di Chimica Organica consiste nel far mettere in Ordine di Acidità i Composti Organici. Perché proprio questa richiesta?
Perché presuppone da parte tua la conoscenza dei gruppi funzionali e di ciò che influenza l’acidità. In questo articolo tenterò di spiegarti tutto nel modo più semplice possibile. Ovviamente, in questo caso non posso dirti che si tratta di una guida completa, perché altrimenti richiederebbe almeno 3-4 articoli lunghi come questo.
Premessa sull’acidità
Il primo consiglio che voglio darti, è quello di memorizzare i pka dei vari composti organici. In genere sconsiglio di imparare a memoria qualcosa, però questo è uno dei pochi casi in cui è necessario farlo. Ti consiglio di vedere direttamente i pka che ti ha assegnato il tuo professore. Ricorda che il pka si ottiene con l’equazione pka= – log ka e che più è basso il pka di una molecola organica e maggiore è la sua acidità.

Esercizi Svolti
Il primo esercizio svolto che ti presento è il più semplice, perché si basa esclusivamente sui pka. Qual’è l’ordine di acidità tra i seguenti composti organici?
- 1-butino
- butano
- 1-butene
- Etanolo
Niente di più semplice, per ordinarli secondo una disposizione crescente, basta ricordare i pka: inizio con il butano (pka ≃ 50), dopodiché l’1-butene (pka ≃ 44), l’1-butino (pka ≃ 25) ed infine l’etanolo (pka ≃ 16). Semplice vero?

Ti mostro un altro po’ di esercizi svolti in modo da farti “entrare nel meccanismo”. O meglio, ti voglio far capire come si dovrebbe ragionare in questi casi.
Esercizio #2
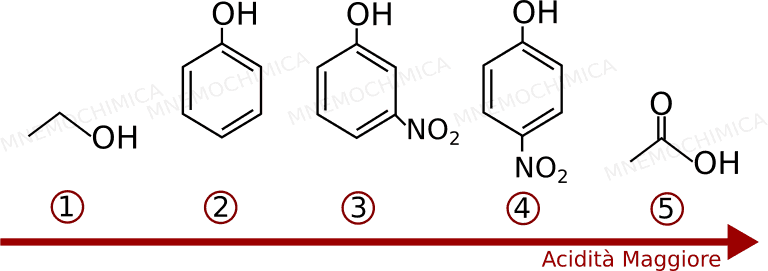
Disponi in ordine di acidità crescente il fenolo, il 3-nitrofenolo, il 4-nitrofenolo, l’etanolo e l’acido etanoico.
Anche in questo caso conoscere i pka (ed i gruppi funzionali) mi aiuta. So che l’etanolo è sicuramente il composto con l’acidità minore, mentre nel gradino più alto posiziono sicuramente l’acido etanoico (pka ≃ 5).

Adesso però devo capire dove posizionare il fenolo, il 3-nitrofenolo ed il 4-nitrofenolo.
Cosa fa il gruppo nitro generalmente? Aumenta l’acidità del composto. Quindi al secondo posto (dopo l’etanolo) posiziono il fenolo.
Qual’è il più acido tra le due molecole rimaste? Il 4-nitrofenolo, sai perché? Quando perde il protone, diventa un composto più stabile, grazie alla struttura di risonanza in più, che nel 3-nitrofenolo invece non c’è.
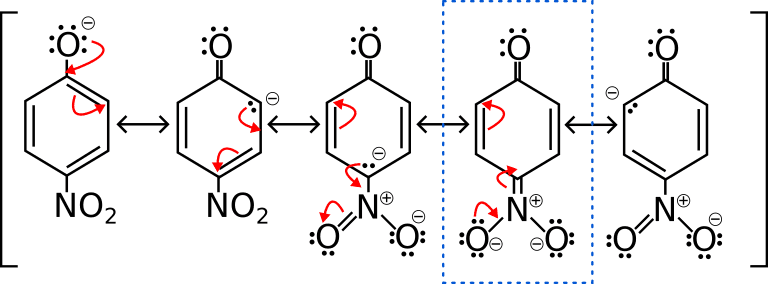
Nel 3-nitrofenolo la carica negativa non va a finire nel carbonio che lega il gruppo nitro, quindi non risuona in quest’ultimo. Però, lo ione coniugato è leggermente stabilizzato dall’effetto induttivo dell’NO2. Proprio per questo motivo la sua acidità è maggiore rispetto al semplice fenolo.
Quindi, ecco la soluzione completa:
Marchia indelebilmente a fuoco nel tuo cervello questo concetto importantissimo: che più è stabile lo ione coniugato e più è forte un acido oppure una base.
Esercizio #3
Ecco un’altro esercizio svolto in cui viene chiesto di mettere in Ordine di Acidità le seguenti molecole Organiche:
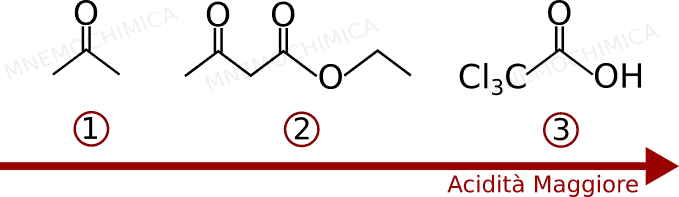
- Acido Tricloroacetico;
- Estere acetacaetico;
- Propanone;
Il composto più acido è sicuramente l’acido tricloroacetico, perché non solo ha il gruppo carbossilico, ma ci sono ben 3 atomi di cloro in posizione alfa (il carbonio vicino a quello del gruppo carbonilico). Bene, gli atomi di cloro, come gli alogeni in generale, hanno un effetto elettron attrattore che aumenta nettamente l’acidità. Pensa che l’acido tricloroacetico ha un pka di circa 0,9 e di conseguenza è migliaia di volte più acido rispetto all’etanoico.
Tra l’estere acetacetico ed il propanone? “Vince” il primo e ti spiego il motivo. Ha ben 2 carboni carbonilici (C=O) vicini all’idrogeno più acido. Questo si traduce in ben 3 strutture di risonanza dello ione coniugato, come ho già mostrato nella Condensazione di Claisen. Se te la sei persa, ecco come sono:
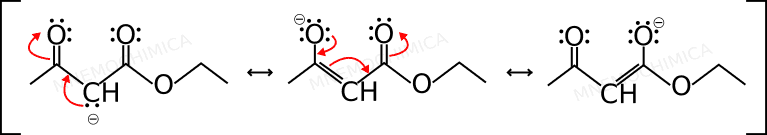
Mentre quelle dello ione coniugato del Propanone sono solo 2, per questo motivo è meno stabile:

Quindi, per riassumere, l’ordine crescente vede il propanone, l’estere acetacetico ed infine (al livello più alto) l’acido tricloroacetico.
Per il momento è tutto… Spero di arricchire questa guida con nuovi esercizi.






