Le reazioni degli alcheni sono molto importanti, soprattutto perché (se le fai bene) possono farti capire al meglio le reazioni della Chimica Organica.
| Ecco cosa vedrai in questa guida (Indice): |
Idrogenazione degli Alcheni
L’idrogenazione permette di trasformare un alchene in un alcano. Come?
Vedi i carboni che fanno parte del doppio legame? Al posto del legame π, legheranno un idrogeno a testa.
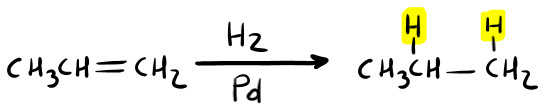
Se utilizziamo l’idrogeno ed il palladio (Pd) oppure il platino (Pt) come catalizzatore, gli idrogeni si addizioneranno dalla stessa parte (SIN).
N.B. Il fatto che si legano dalla stessa parte ti interesserà solo se si forma un centro chirale oppure negli alchini.
Idrogenazione degli Alcheni: Esercizi svolti
Vediamo 3 semplici esercizi svolti.
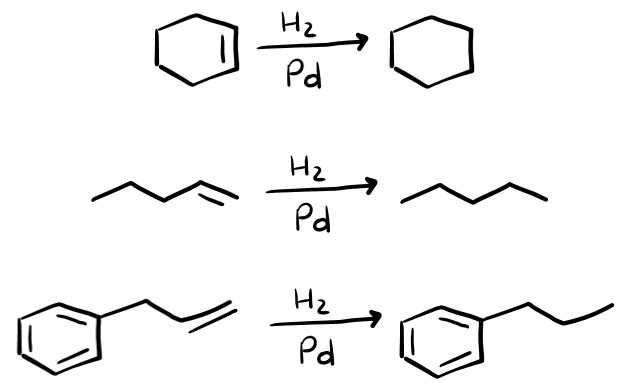
Nel primo abbiamo un cicloesene che diventa un cicloesano. Nel secondo caso un 1-pentene diventa un pentano. L’ultimo esercizio svolto è molto interessante, perché come puoi vedere c’è un anello aromatico (benzene). Vedrai infatti che i composti aromatici non reagiscono con le reazioni degli alcheni, dunque agisci solo sul doppio legame presente a destra.
Addizione di Acidi Alogenidrici (idroalogenazione degli alcheni)
Avviene quando fai reagire un alchene con un acido alogenidrico (es: HCl o HBr). Si tratta di un’addizione elettrofila che segue la regola di Markovnikov, infatti:
- l’idrogeno (elettrofilo) si lega al carbonio meno sostituito (con più idrogeni);
- l’alogeno (nucleofilo) si lega al C del doppio legame più sostituito;
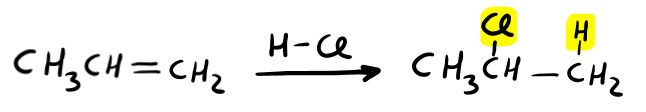
Meccanismo
Nel primo stadio, usi gli elettroni del doppio legame per legare l’idrogeno. Questo non può formare 2 legami e dunque cede gli elettroni di legame all’alogeno. Questo è lo stadio lento, perché porta alla formazione di un intermedio molto instabile: il carbocatione.
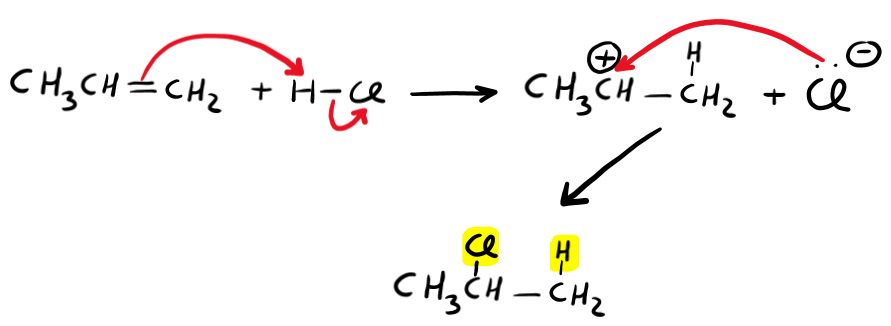
Il secondo step è lo stadio veloce, perché leghi il nucleofilo (X– , Cl– nell’immagine) al carbocatione, neutralizzando entrambe le cariche (dunque torni ad una situazione stabile).
Come capire il discorso della stabilità/instabilità?
Puoi paragonarla alla comodità. Se ti dicono di metterti a studiare in ginocchio sui ceci, non fai di certo i salti di gioia per farlo! Allo stesso modo la formazione del carbocatione non è “piacevole” per le molecole e dunque avviene lentamente.
Mentre invece se ti dicono di passare dallo studiare in ginocchio sopra i ceci ad una poltrona comodissima, ci vai subito 🙂 (e questo è un po’ il secondo step della reazione).
Ovviamente questo è un discorso che vale sempre quando si formano i carbocationi.
Se l’alchene è simmetrico?
Se non c’è un carbonio più o meno sostituito tra i due del doppio legame, si legano in modo indifferente.
Se nel prodotto si forma un centro chirale?
L’intermedio è un carbocatione, dunque l’orbitale vuoto è l’orbitale p. Questo è presente sia sopra che sotto il piano, ragion per cui il nucleofilo può legarsi sia sopra che sotto (ottenendo così 2 prodotti diversi).
Spiegato in parole povere? Ottieni sia il prodotto (R) che (S), entrambi gli enantiomeri.
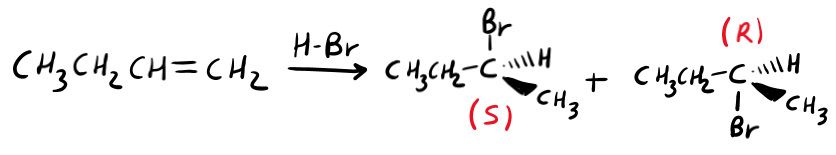
Mattè, ma se non so come disegnare i prodotti? Se non so come disporre gli atomi? Scrivili come cavolo ti pare, l’importante è che un centro chirale è (R) e l’altro (S).
Alogenazione
L’alogenazione permette di ottenere un dialogenuro vicinale. Ovvero un composto in cui ci sono due alogeni legati a carboni adiacenti. Si fa reagire l’alchene con l’alogeno molecolare (Cl2 o Br2), in un solvente (generalmente CCl4).
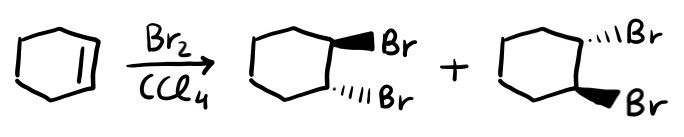
Come puoi vedere dall’immagine, i due alogeni si legano da parti opposte (addizione ANTI). Ottieni sempre prodotti ANTI quando hai come intermedio un ponte (chiamato: intermedio bromonio/cloronio a ponte).
Vediamo il meccanismo della reazione.
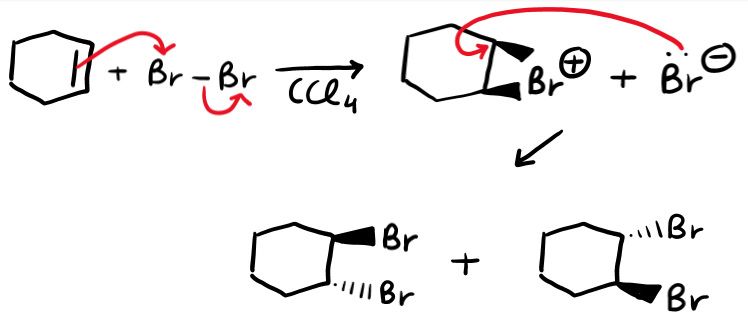
La vicinanza del doppio legame, polarizza l’alogeno molecolare (l’atomo più vicino diventa parzialmente carico + e l’altro parzialmente -). Dunque usi gli elettroni del legame π per legare l’atomo elettrofilo che a sua volta forma l’intermedio a ponte.
Nel secondo passaggio, X– (in questo caso Br–) si comporta da nucleofilo e si lega ad uno dei 2 carboni del ponte (se c’è un carbonio più sostituito si lega a quello).
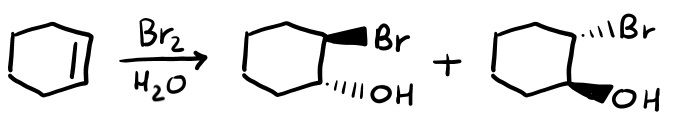
Alogenazione in Acqua (Formazione di Aloidrine)
Se facciamo un alogenazione in ambiente acquoso, otteniamo un’aloidrina. Ovvero un composto in cui è presente sia l’alogeno che il gruppo ossidrile (OH).
Vedrai che il meccanismo è molto simile. Per spiegartelo semplicemente ho deciso di dividerlo in 3 step. Come puoi vedere in basso, il primo step è lo stesso. Vedi l’immagine perché poi ti commento gli altri 2 step.
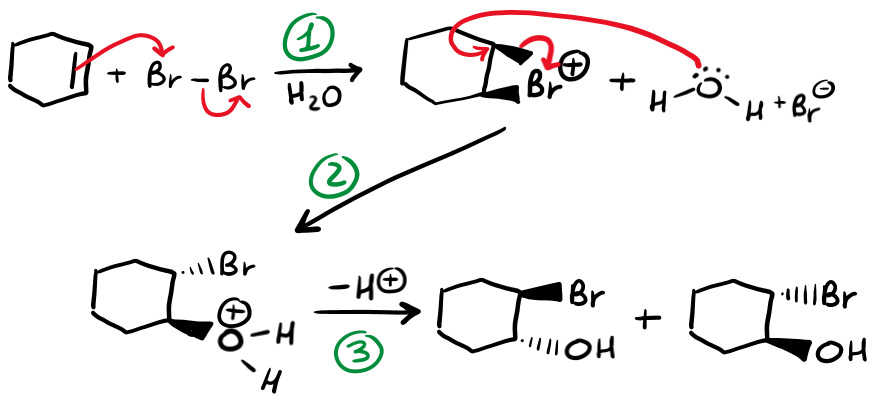
Nel secondo step, al posto di legarsi l’alogenuro si lega l’acqua (che si comporta da nucleofilo). Quest’ultima si lega al carbonio del ponte più sostituito (in questo caso sono sostituiti allo stesso modo quindi è indifferente). Infine, nell’ultimo step devi deprotonare (“togliere” un H+) dall’acqua in modo da neutralizzare la carica + dell’ossigeno.
Visto che l’intermedio è sempre a ponte, ottieni solo i prodotti anti (come vedi infatti il bromo e l’OH si legano da parti opposte).
Sintetizzare un alcol da un alchene
Le reazioni degli alcheni che stiamo per vedere, permettono di trasformare un alchene in un alcol. Sono tre:
- idratazione acido catalizzata;
- ossimercuriazione-riduzione;
- idroborazione-ossidazione;
Le prime 2 seguono la regola di Markovnikov, dunque nel prodotto finale otterrai L’OH sul carbonio più sostituito e l’H sul meno sostituito. Invece, nell’idroborazione avviene il contrario. Infatti si parla di anti-markovnikov. Vedrai che questo dipende dal reagente che usi, il borano (BH3).
Idratazione degli alcheni (con H2SO4)
Si tratta di un’addizione elettrofila e come detto prima, segue la regola di Markovnikov (OH sul carbonio più sostituito e H sul meno sostituito).
Se vuoi vedere questa reazione in modo specifico ti consiglio di andare in questa guida con la teoria e gli esercizi sull’idratazione.
Si utilizza l’acqua più l’acido solforico come catalizzatore. Dunque a volte troverai scritto H2O, H2SO4 oppure H3O+ (che significa genericamente acqua in ambiente acido) oppure H+/H2O.
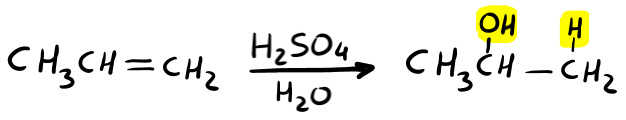
Vediamo adesso il meccanismo della reazione.
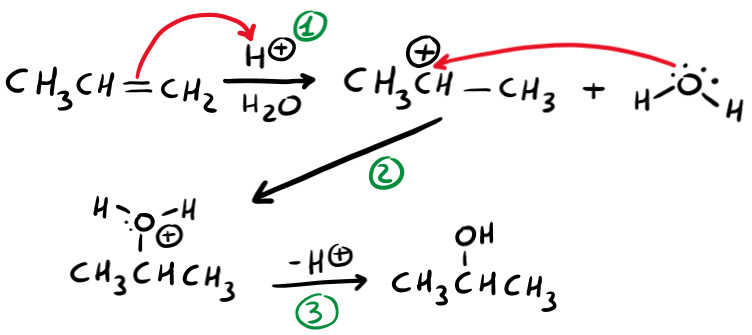
Dividiamo tutto in 3 step:
- La reazione con l’acido solforico (che puoi indicare con H+), fa in modo che si leghi l’H sul carbonio meno sostituito, mentre nell’altro carbonio del doppio legame si forma il carbocatione;
- L’acqua si lega al carbonio carico +;
- Per neutralizzare la carica dell’ossigeno si deprotona (rimuove un idrogeno);
Caratteristiche principali:
- carbocatione come intermedio;
- segue la regola di Markovnicov;
Ossimercuriazione-Riduzione
L’ossimercuriazione-riduzione è una reazione degli alcheni che permette di ottenere sempre il prodotto Markovnikov, ma ha una differenza importantissima. Al posto del carbocatione, hai l’intermedio a ponte, di conseguenza:
- eviti il problema delle trasposizioni (dovuto al carbocatione);
- l’addizione è ANTI (come sempre quando c’è il ponte);
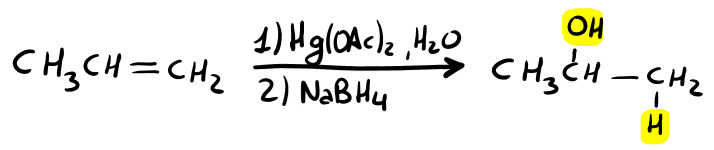
Come reagenti si usano l’acetato di mercurio [ Hg(OAc)2 ] in acqua e nel secondo step NaBH4 (che è per l’appunto un riducente).
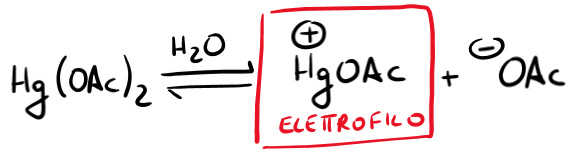
Vediamo il meccanismo della reazione. Per prima cosa, in acqua otteniamo l’elettrofilo che ci servirà per la reazione.
Una volta formato l’elettrofilo (quello che ti ho cerchiato in rosso) lo facciamo reagire con l’alchene e si formerà l’intermedio a ponte mercurinio.
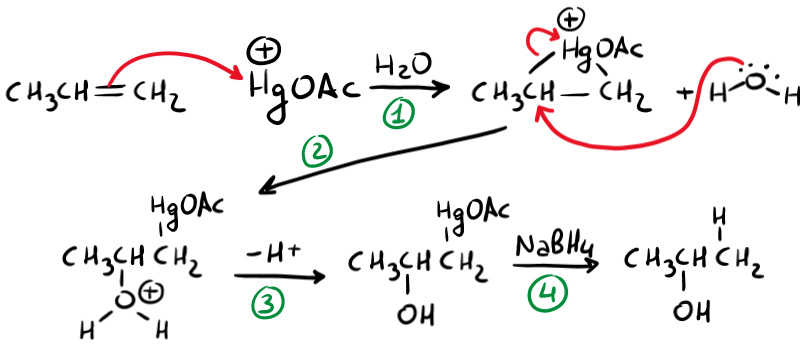
Una volta formato il ponte, l’acqua si lega al carbonio più sostituito. Poi devi deprotonare (togliere un H+) l’ossigeno per neutralizzare la carica positiva. Infine riduci la porzione HgOAc (la sostituisci con un idrogeno) grazie all’NaBH4 (sodio boroidruro).
Idroborazione-Ossidazione
In questa reazione userai un escamotage per legare il gruppo OH al carbonio meno sostituito (anti-Markovnikov). Come? Normalmente è l’idrogeno a comportarsi da elettrofilo, invece utilizzando il BH3 (borano):
- l’atomo di Boro (B) si comporta come un elettrofilo;
- l’H+ si comporta da nucleofilo;
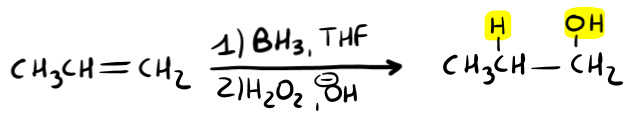
Vediamo come funziona la reazione in modo ultra semplificato (è troppo lungo il meccanismo per vederlo qui).
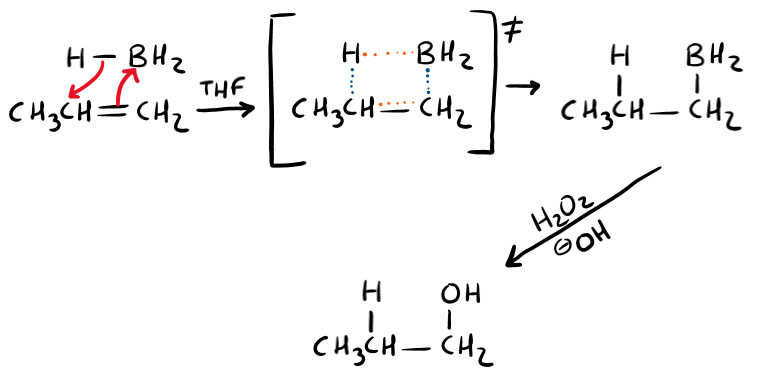
L’aspetto più importante che volevo farti notare qui (che chiedono spesso i professori) è l’intermedio a quattro centri. Si tratta di uno stato di transizione (per questo è rappresentato tra parentesi quadre). Te lo spiego nel modo più semplice possibile.
Immagina di fermare il tempo, in quell’esatto momento vedi che: stai usando gli elettroni del doppio legame per legare il boro.
Come indichi che un legame si sta formando/rompendo? Tratteggiandolo. Quindi tratteggi il doppio legame ed il nuovo legame con il boro. Poi si sta rompendo quello B-H perché gli elettroni li usi per legare l’idrogeno al carbonio. Quindi tratteggi anche questi 2 legami.
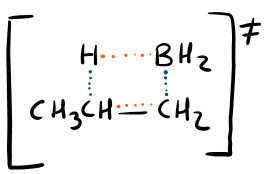
Per semplicità ti ho colorato in blu i legami che si stanno formando ed in arancione quelli che si stanno rompendo.
Qual’è un aspetto che puoi notare? Nello stato di transizione si vede che il boro e l’idrogeno si legano dalla stessa parte, dunque si tratta di un’addizione SIN (ricordalo quando scrivi i prodotti). Nell’ultimo step (ossidazione), trasformi il Boro in un gruppo OH grazie all’acqua ossigenata in ambiente basico (H2O2 in –OH).
Epossidazione degli Alcheni
L’epossidazione permette di ottenere un epossido. Cos’è l’epossido? Si tratta di un ciclo in cui uno degli atomi è un ossigeno.
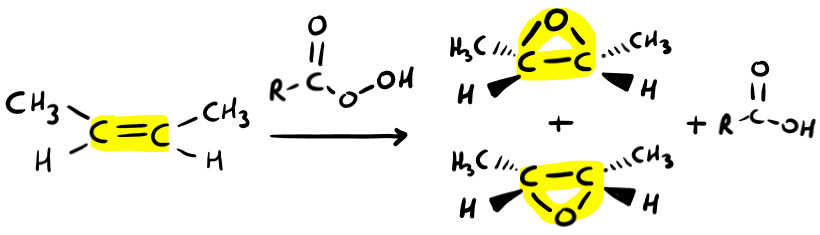
Come reagente si usa un perossiacido, indicato in modo generico con RCOOOH. Qualche volta troverai scritto MCPBA (acido meta-cloroperossibenzoico). Ti basta ricordare che se trovi scritto MCPBA o RCOOOH è esattamente la stessa cosa.
Caratteristiche da ricordare:
- Addizione SIN (i due legami con l’ossigeno sono dalla stessa parte – nei cicli puoi mostrarli entrambi sul cuneo pieno + entrambi sul tratteggiato);
- Non confondere un acido carbossilico con un perossiacido (quest’ultimo ha un ossigeno in più e la presenza di 2 ossigeni vicini lo rende instabile);