[one_fourth]Cos’è il gruppo carbonilico (o carbonile) e perché è così importante questo gruppo funzionale nella chimica organica? Ti mostrerò tutto per bene in questa guida. Innanzitutto il carbonile è formato da un carbonio che fa un doppio legame con un ossigeno (C=O). Qui sotto 2 esempi di gruppo carbonilico nella benzaldeide e nell’acetofenone (rispettivamente un’aldeide ed un chetone).


Ti faccio toccare con mano (nel dettaglio) le altre caratteristiche…
Caratteristiche del Gruppo Carbonilico
Ibridazione Sp2
L’atomo di carbonio è ibridato Sp2 (lo stesso vale per l’ossigeno), e di conseguenza i legami σ si trovano ad una distanza di circa 120° tra loro. Perché sono ibridati Sp2? Semplice, il carbonio e l’ossigeno se formano un doppio legame, devono per forza essere ibridati Sp2.
Ricorda: doppio legame = ibridazione sp2.
Polarità
Non è tutto, perché il carbonile ha la caratteristica di essere polare, si perché ci sono 2 cariche parziali: positiva (δ+) e negativa (δ–). Come mai? Si spiega grazie alla differenza di elettronegatività tra il carbonio e l’ossigeno, dove quest’ultimo è più elettronegativo.
Ragion per cui l’ossigeno tende ad attrarre verso di sé gli elettroni di legame, e la conseguenza è che il carbonio diventa parzialmente povero di elettroni (elettrofilo) e viceversa l’ossigeno parzialmente nucleofilo. Puoi vedere il tutto nell’immagine animata sottostante.
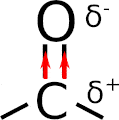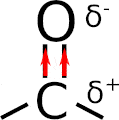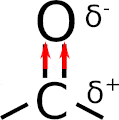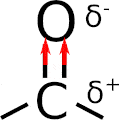
Proprio quest’ultima caratteristica spiega le reazioni dei composti carbonilici, che coinvolgono molto spesso proprio il carbonio elettrofilo. Un esempio sono le aldeidi ed i chetoni, che reagiscono seguendo il meccanismo di addizione nucleofila.
Una tipologia di addizione nucleofila che riguarda le Aldeidi ed i chetoni, è quella che avviene con i reattivi di Grignard per la sintesi degli alcoli.
Acidità
Il gruppo carbonilico aumenta l’acidità dei composti, ed in particolare degli idrogeni legati all’atomo in alfa. Cosa cavolo sto dicendo? Te la faccio più semplice.
Prendi un propano, questo ha pka di circa 50. Adesso, schiaffaci un gruppo carbonilico e vedrai che il pka scende drasticamente ad un pka di 17/20. Ricorda ovviamente che più basso è il pka e maggiore è l’acidità e che si parla in scala logaritmica, quindi è “solo” oltre un triliardo di volte più forte.
Come si spiega ciò? Lo scoprirai tra pochissimo.
Stabilità della base coniugata
Come non smetterò mai di ripetere, più è stabile la base coniugata e più è forte l’acido. Il gruppo carbonilico stabilizza lo ione coniugato per risonanza (tieni anche presente che più strutture limite ci sono e – generalmente – maggiore è la stabilità). Inoltre, la carica negativa finisce in una risonanza sull’ossigeno, che è più elettronegativo del carbonio e di conseguenza “regge” meglio la carica negativa.

Nomenclatura
Per assegnare il nome IUPAC a questi composti, ti consiglio di dare un’occhiata agli esercizi sulla nomenclatura dei composti organici che trovi qui. Un’altra pagina che ti consiglio è quella che riguarda la nomenclatura delle aldeidi e dei chetoni.
[ipt_fsqm_form id=”58″]